Altillo.com
> Exámenes > UBA
- Ciencias Exactas > Química
|
Química |
3° Parcial |
2° Cuat. de 1999 |
Altillo.com |
Problema 1
En un litro de agua se tiene una mezcla de 0.01 mol de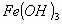 y 0.01 mol de
y 0.01 mol de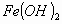 sólidos.
sólidos.
a) ¿A qué valores de pH la concentración del ion metálico del compuesto más
soluble excede la solubilidad?
b) ¿Cuál es la concentración del ion metálico del hidróxido más soluble
cuando la concentración de 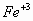 en la solución acuosa es igual a la solubilidad del
en la solución acuosa es igual a la solubilidad del 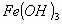 ?
Considere que los cationes metálicos no se hidrolizan.
?
Considere que los cationes metálicos no se hidrolizan.
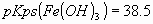
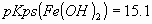
Problema 2
Un litro de agua de lluvia contiene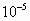 moles
de HCI,
moles
de HCI, 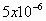 moles
de
moles
de 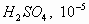 moles
de
moles
de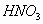 ,
y
,
y 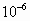 moles
de un ácido orgánico de pKa = 6.
moles
de un ácido orgánico de pKa = 6.
a) Calcule el pH del agua de lluvia.
b) Indique si las siguientes afirmaciones son verdaderas o falsas. Justifique
todas sus respuestas.
i) La disolución de dióxido de carbono disminuye el pH del agua de lluvia. No
haga cuentas, 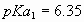 ;
;
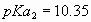 ;
;
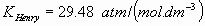 ;
;
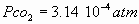
ii) La disolución de cloruro de sodio aumenta el pH del agua de lluvia.
iii) El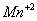 proveniente
del material particulado suspendido en la atmósfera es oxidado por oxígeno en
la fase acuosa para dar
proveniente
del material particulado suspendido en la atmósfera es oxidado por oxígeno en
la fase acuosa para dar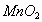 .
Dicho proceso aumenta el pH del agua de lluvia.
.
Dicho proceso aumenta el pH del agua de lluvia.
Problema 3
a) Calcule el pH y las concentraciones de todas las especies en el equilibrio
de una solución formada por 250 ml de HCOOH 0.100 M (pKa = 3.75) y 250 ml de
HCOONa 0.050 M, A 25°C.
Justifique todas las aproximaciones realizadas (Dato
pKw = 14.0)
b) Si a la solución anterior se le agregan 0.025 moles de NaOH (sin cambio
de volumen) calcule el nuevo valor de pH y explique si se producirá un aumento
o disminución en el poder regulador de la solución.
Problema 4
En uno de los compartimentos de una celda electroquímica se coloca un
electrodo de cobre y 100 ml de una solución de CuSO4 1M mientras que el otro
compartimento se coloca un electrodo de cinc y 100 ml una solución de ZnSO4 1M.
Ambos compartimentos están separados por una membrana permeable al ion sulfato.
Se hace circular corriente de manera que el electrodo de cinc tenga polaridad
negativa y se realiza una electrólisis.
Datos: 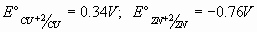
a) Indicar
i) que reacciones ocurren en cada electrodo. Escriba todas las reacciones
posibles y justifique.
ii) si se hace circular una corriente de 0.94A durante cuatro horas ¿cuál
será la concentración resultante en cada compartimento?
b) Si el dispositivo resultante del experimento anterior se utiliza como pila
indicar:
i) El potencial de la pila.
ii) La polaridad de los electrodos.
iii) La circulación de cargas si se conectan ambos electrodos entre si.
Para resolver los puntos i), ii) y iii) de la parte b) Ud. debe utilizar los
resultados del punto ii) de la parte a). Si no pudo calcular las concentraciones
resultantes de la electrólisis utilice cualquier valor de concentración que
Ud. considere razonable.