Altillo.com > Exámenes > UBA - Farmacia y Bioquímica > Física
| Física | Trabajo Práctico: Espectroscopía | 2006 | Altillo.com |
1- Absorción molecular.
OBJETIVO:
Comparar y analizar distintos espectros de absorción molecular, empleando un espectrofotómetro.
FUNDAMENTO:
Se basa en la absorción de radiación electromagnética que presentan las moléculas, que al ser analizadas con un espectrofotómetro según Abs= f(λ) se obtiene un barrido espectral.
MATERIALES:
- Espectrofotómetro Jenway 6300 Nº6.
- Cubetas plásticas.
- Solución de azul de metileno.
- Solución de p-nitro fenol.
- Solución mezcla (1 : 1) de las soluciones anteriores
- Pipetas de 5
DATOS:
Paso óptico de la cubeta = 1,0 cm
Sensibilidad del espectrofotómetro = 0,001
MÉTODO:
- Preparar la solución mezcla de colorantes, mezclando adecuadamente volúmenes iguales de los mismos.
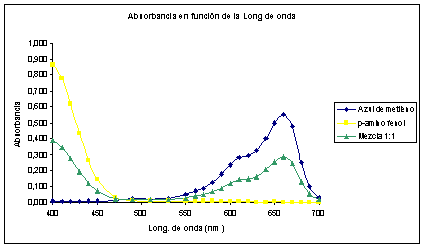
- Hacer un barrido espectral entre 400-700 nm, leyendo cada 10 nm entre 400-450 y 550-700 nm; y cada 20 nm entre 450-550 nm. Llevar a cero con agua antes de realizar cada lectura y leer consecutivamente las soluciones de azul de metileno, p-nitro fenol y mezcla.
- Graficar Abs = f(λ), y analizar el gráfico.
RESULTADOS:
|
Long onda (nm) |
Azul de metileno |
p-nitro fenol |
mezcla (1 : 1) |
|
Abs (± 0,001) |
Abs (± 0,001) |
Abs (± 0,001) |
|
|
400 |
0,007 |
0,862 |
0,387 |
|
410 |
0,006 |
0,780 |
0,348 |
|
420 |
0,006 |
0,617 |
0,274 |
|
430 |
0,006 |
0,432 |
0,193 |
|
440 |
0,009 |
0,262 |
0,119 |
|
450 |
0,011 |
0,143 |
0,069 |
|
470 |
0,014 |
0,032 |
0,023 |
|
490 |
0,021 |
0,014 |
0,018 |
|
510 |
0,020 |
0,011 |
0,017 |
|
530 |
0,027 |
0,008 |
0,018 |
|
550 |
0,051 |
0,009 |
0,028 |
|
560 |
0,070 |
0,009 |
0,039 |
|
570 |
0,090 |
0,007 |
0,049 |
|
580 |
0,124 |
0,007 |
0,065 |
|
590 |
0,176 |
0,006 |
0,088 |
|
600 |
0,236 |
0,006 |
0,118 |
|
610 |
0,278 |
0,006 |
0,140 |
|
620 |
0,292 |
0,004 |
0,146 |
|
630 |
0,325 |
0,001 |
0,162 |
|
640 |
0,399 |
0,002 |
0,204 |
|
650 |
0,496 |
0,003 |
0,253 |
|
660 |
0,553 |
0,002 |
0,286 |
|
670 |
0,474 |
0,000 |
0,244 |
|
680 |
0,251 |
0,000 |
0,131 |
|
690 |
0,096 |
0,000 |
0,052 |
|
700 |
0,030 |
0,000 |
0,018 |

DISCUSIÓN y CONCLUSIÓN:
Se puede comprobar la relación entre el color macroscópico de la solución y la longitud de onda de máxima absorción, siendo con el azul de metileno el color azul y la absorbancia máxima en aproximadamente 650 nm zona del naranja, es decir el color complementario, para el p-nitro fenol el color amarillo y la absorbancia máxima en aproximadamente 400 nm zona del violeta, también su color complementario y por último la solución mezcla de color verde, con absorbancias máximas a 650 nm y 400 nm.
En referencia al gráfico del barrido, la relación entre los espectros individuales y la mezcla es una diferencia punto a punto, quedando la curva de la mezcla entre medio de las dos individuales, ya que se diluyen las concentraciones originales.
2- Absorción molecular.
OBJETIVO:
Analizar distintos espectros de absorción molecular, de modo cualitativo, empleando luz natural y el ojo del observador o un espectroscopio como analizador.
FUNDAMENTO:
Se basa en la absorción de radiación electromagnética que presentan las moléculas, que al ser analizadas con un espectroscopio se obtiene un espectro de bandas .
MATERIALES:
- Fuente de luz natural.
- Espectroscopio.
- Frascos con soluciones de distintos colorantes.
MÉTODO:
- Colocar los frascos con soluciones de diferentes colorantes entre la fuente de luz natural y el analista, y observar la variación de intensidad, aparición, desaparición o formación de colores, haciendo variar la longitud de paso de la luz, esto es colocando los frascos en forma longitudinal o transversal.
- Repetir la experiencia anterior, pero ahora interponiendo un espectroscopio enter el frasco de colorante y el analista, observando las variaciones que se producen en el espectro de colores.
RESULTADOS:
|
Sustancia |
Color c/luz natural |
Obs. al espectroscopio |
|
p-amino fenol |
Amarillo |
Todo el espectro menos el violeta |
|
Azul de metileno |
Azul |
Se ve solo la zona del violeta |
|
Verde brillante |
Verde |
Todo el espectro |
|
Rojo de fenol básico |
Rojo |
Se ve solo la zona del rojo |
|
Rojo de fenol ácido |
Naranja |
Se ven las bandas roja, amarilla y verde |
|
Rojo Ponceau básico |
Rojo amarronado |
Se ve solo la zona del rojo |
Con luz natural desde la izquierda:
Verde detergente: observando longitudinalmente el frasco, se observa verde la zona de la izquierda y más amarillo la zona de la derecha.
DISCUSIÓN y CONCLUSIÓN:
En esta experiencia y utilizando otro aparato de medición o lectura, también se comprueba que según el color de la solución (color emitido) en el espectroscopio se observa la absorción del color complementario
3- Emisión atómica.
OBJETIVO:
Observar los colores producidos por soluciones de cationes rociados sobre una llama.
FUNDAMENTO:
Se basa en la observación de la emisión de energía que queda retenida por un catión, luego que es excitado por vía térmica y que se desexcita por vía lumínica.
MATERIALES:
- Mechero.
- Rociadores con soluciones de distintos cationes.
MÉTODO:
- Con la luz apagada, rociar sobre la llama las soluciones de los distintos cationes y observar los colores que aparecen.
RESULTADOS:
|
Catión |
Color solución |
Color a la llama |
|
Litio |
Incoloro |
Fucsia |
|
Sodio |
Incoloro |
Amarillo |
|
Calcio |
Incoloro |
Naranja |
|
Bario |
Incoloro |
Amarillo |
|
Cobre |
Azul |
Verde |
|
Estroncio |
Incoloro |
Naranja |
DISCUSIÓN y CONCLUSIÓN:
No se realizó esta experiencia analizando paralelamente con un espectroscopio, por lo que solo se puede concluir que iones en solución, por más que esta solución sea incolora, imparte a la llama un color característico para cada catión.
4- Emisión atómica.
OBJETIVO:
Cuantificar cationes Na+ y K+ utilizando un espectrofotómetro de llama.
FUNDAMENTO:
Se basa en la medición de la emisión de energía que queda retenida por un catión, luego que es excitado por vía térmica y que se desexcita por vía lumínica.
MATERIALES:
- Espectrofotómetro de llama.
- Solución patrón de Na+ y K+.
- Soluciones muestra A y B de Na+ y K+.
- Agua destilada.
- Matraces de 100 ml.
- Pipetas de 1 ml.
DATOS:
Concentración solución patrón: Na+= 150 meq/l
K+= 5 meq/l
Sensibilidad espectrofotómetro: Na+= ± 1
K+= ± 0,1
Aproximación del matraz= ± 0,1 ml
MÉTODO:
- Encender el espectrofotómetro y el mechero del mismo, teniendo la precaución de que la llama sea de conos chicos.
- Preparar diluciones de las soluciones patrón, muestra A y muestra B, midiendo 1 ml y llevando a volumen con agua en un matraz aforado de 100 ml.
- Seleccionar la opción de trabajo para Sodio, de manera tal que se filtren todas las demás emisiones de longitudes de onda.
- Llevar la escala a cero con agua y a continuación leer la solución diluída patrón, observando los valores mínimos y máximos que marca en la escala, y hacer un promedio para determinar un valor arbitrario de la ecala para la solución patrón.
- A continuación leer las soluciones diluídas muestra A y muestra B, es ese orden e intercalando agua entre cada lectura.
- Repetir los pasos anteriores, pero seleccionando la opción de trabajo para Potasio.
- Calcular las concentraciones en meq/l de Na+ y K+ en las soluciones originales.
RESULTADOS:
Lecturas
|
|
Na+, lect (±1) |
K+, lect (±0,1) |
|
Testigo |
100 |
9 |
|
Muestra A |
91 |
6,5 |
|
Muestra B |
89 |
5,8 |
Concentración
|
|
Na+, meq/l |
K+, meq/l |
|
Muestra A |
137 ± 4 |
3,6 ± 0,8 |
|
Muestra B |
134 ± 4 |
3,2 ± 0,7 |
DISCUSIÓN y CONCLUSIÓN:
Se puede utilizar este método para cuantificar cationes en solución, mediante la relación entre la intensidad de la luz emitida y la concentración de cada catión, que se ve reflejada como un valor en el display.
Anexo cálculos auxiliares:
MA= (LMA . P . dM) / (LP . dP)
Donde MA es la concentración en meq/l de muestra A (o B); LMA es la lectura de la muestra diluída A (o B); P es la concentración en meq/l del patrón de Na+ o K+ ; dM es la dilución de la solución muestra; LP es la lectura de la solución patrón y dP es la dilución de la solución patrón.
ΔMA= ((ΔLMA /LMA ) + (ΔP/P) + (ΔdM /dM ) + (ΔLP/LP) + (ΔdP /dP)) . MA
Concentración Na+
MA= (91 . 150 . 100) / (100 . 100)= 136,5 meq/l
ΔMA= ((1/91) + (1/150) + (0,1/100) + (1/100) + (0,1/100)) . 136,5= 4,048 meq/l= 4 meq/l
MA= (137 ± 4) meq/l
MB= (89 . 150 . 100) / (100 . 100)= 133,5 meq/l
ΔMB= ((1/89) + (1/150) + (0,1/100) + (1/100) + (0,1/100)) . 133,5= 3,992 meq/l= 4 meq/l
MB= (134 ± 4) meq/l
Concentración K+
MA= (6,5 . 5 . 100) / (100 . 100)= 3,6111 meq/l
ΔMA= ((0,1/6,5) + (1/5) + (0,1/100) + (0,1/9) + (0,1/100)) . 3,6111= 0,825123456 meq/l= 0,8 meq/l
MA= (3,6 ± 0,8) meq/l
MB= (5,8 . 5 . 100) / (100 . 100)= 3,2222 meq/l
ΔMA= ((0,1/5,8) + (1/5) + (0,1/100) + (0,1/9) + (0,1/100)) . 3,2222= 0,742246913 meq/l= 0,4 meq/l
MB= (3,2 ± 0,7) meq/l