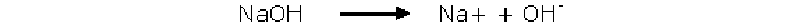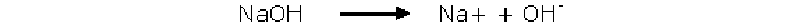
Altillo.com > Exámenes > UBA - Farmacia y Bioquímica > Química General e Inorgánica I
| Química General e Inorgánica | Trabajo Práctico nº6: soluciones reguladoras de ph | 2007 | Altillo.com |
Objetivos:
1.
2. Comprobar la capacidad reguladora y el efecto de la dilución sobre la misma
3. Construir curvas de titulación acido fuerte – base fuerte y acido débil – base fuerte.
Materiales y reactivos:
+
+ Espátula
+ Matraces
+ Bureta
+ pHmetro
+ Acido acético glacial
+ Acetato de sodio
+ Acido nítrico
+ Hidróxido de sodio
+ Agua destilada
Procedimiento:
Realizado en base a la Guía de Seminarios y Trabajos Prácticos de Química General e Inorgánica, paginas 216 y 217
Resultados:
Experimento 1
pH Buffer HAC/NaAC =4,38
Experimento 2:
| pH | |
| Tubo 1 | 4.83 |
| Tubo 2 | 4.63 |
| Tubo 3 | 4.95 |
| Tubo 4 | 4.92 |
| Tubo 5 | 1.80 |
| Tubo 6 | se fue de escala |
Experimento 3:
Dilución buffer ¼ + HNO3
| Volumen de acido agregado (ml) | pH |
| 0 | 4.80 |
| 4 | 4.42 |
| 8 | 3.99 |
| 12 | 3.10 |
| 16 | 2.09 |
| 20 | 1.82 |
Dilución buffer ½ + HNO3
| Volumen de acido agregado (ml) | pH |
| 0 | 4.79 |
| 4 | 4.61 |
| 8 | 4.45 |
| 12 | 4.29 |
| 16 | 4.11 |
| 20 | 3.90 |
Dilución buffer ¼ + NaOH
| Volumen de acido agregado (ml) | pH |
| 0 | 4.83 |
| 4 | 5.24 |
| 8 | 6.73 |
| 12 | 13.91 |
| 16 | >14 |
| 20 | >14 |
Dilución buffer ½ + NaOH
| Volumen de acido agregado (ml) | pH |
| 0 | 4.77 |
| 4 | 4.96 |
| 8 | 5.18 |
| 12 | 5.49 |
| 16 | 6.14 |
| 20 | 13.51 |
Experimento 4:
| Volumen | pH |
| 0 | 1.25 |
| 5 | 1.46 |
| 10 | 1.68 |
| 15 | 2.02 |
| 17.5 | 2.31 |
| 20 | 3.34 |
| 22.5 | 11.10 |
| 25 | 12.01 |
Experimento 5:
| Volumen | pH |
| 0 | 3 |
| 5 | 4.36 |
| 10 | 4.92 |
| 12.5 | 5.25 |
| 15 | 5.82 |
| 17.5 | 11.43 |
| 20 | 12.08 |
| 22.5 | 12.15 |
| 25 | 13 |
Conclusiones:
Experimento 1:
Estamos creando una solución reguladora, es decir una solución que tiene la característica de mantener casi constante su pH a pesar del agregado de un acido o una base.
En este caso es un sistema Acido-Sal, ya que esta formado por un acido débil (acido acético) y una sal de ese acido y una base fuerte (acetato de sodio)
Experimento 2:
Comparamos la capacidad amortiguadora del buffer en comparación con el agua destilada.
Como era de esperar, las soluciones de buffer con acido o base disueltos, tuvieron una variación mínima de pH, mientras que las soluciones de agua destilada con acido o base, sufrieron grandes cambios, llegando la de base incluso a irse de la escala.
Agregado de Acido:
Aumenta la concentración de protones, por lo tanto aumentan los moles de acido, disminuyen los moles de sal y disminuye el pH
Agregado de Base:
Aumentan la concentración de aniones hidroxilo, por lo tanto disminuyen los moles de acido, aumentan los moles de sal y aumenta el pH
Experimento 3:
Comprobamos que al diluir el buffer el rango útil no cambia pero si cambia la capacidad reguladora.
Es decir que ante el agregado de iguales cantidad de ácido o base es mayor la diferencia de pH en el caso del buffer más diluido, que para el más concentrado. Esto se debe a que el cociente entre las concentraciones de los componentes del buffer (ácido y sal), disminuye o aumenta en igual proporción, es constante.
pH = pka + log [ sal ]
[ácido]
Cuanto mayor sea la dilución del buffer, menor será la capacidad reguladora.
Experimento 4:
Curvas de titulacion de un Acido fuerte con una Base fuerte
En este grafico el pH comienza subiendo lentamente y luego sube abruptamente para luego volver a subir lentamente.
El punto final se encuentra en el pH = 7, punto en el que son neutralizados todos los moles de ácido que hay en la solución.
Experimento 5:
Curvas de titulacion de un Acido débil con una Base fuerte
Este grafico forma una meseta, zona del grafico llamada zona buffer. La capacidad reguladora máxima esta dada cuando el pH es igual al pKa y se sitúa en el punto donde el agregado de base es la mitad de lo que debería colocarse para llegar al punto de equivalencia.
El rango útil se encuentra entre pKa + 1, que es la meseta de la curva. Esto se debe a que, en ese rango, la variación de pH, ante el añadido de base, es muy pequeña porque esta está neutralizada.
En este caso el punto de equivalencia tiene un pH=8 (básico) debido a que la sal hidroliza y forma OH-