Altillo.com > Exámenes > UBA - CBC > Química
Magnitudes atómico-moleculares
Una magnitud física es una propiedad o cualidad medible de un sistema físico, es decir, a la que se le pueden asignar distintos valores como resultado de una medición o una relación de medidas. Las magnitudes físicas se miden usando un patrón que tenga bien definida esa magnitud, y tomando como unidad la cantidad de esa propiedad que posea el objeto patrón. Por ejemplo, se considera que el patrón principal de longitud es el metro en el Sistema Internacional de Unidades.
Las primeras magnitudes definidas estaban relacionadas con la medición de longitudes, áreas, volúmenes, masas patrón, y la duración de periodos de tiempo.
El actual modelo de la estructura atómica es el modelo mecánico cuántico. La química tradicional comenzó con el estudio de las partículas elementales: átomos, moléculas, sustancias, metales, cristales y otros agregados de la materia. La materia podía ser estudiada en estados líquido, de gas o sólidos, ya sea de manera aislada o en combinación. Las interacciones, reacciones y transformaciones que se estudian en química son generalmente el resultado de las interacciones entre átomos, dando lugar a reordenamientos de los enlaces químicos que los mantienen unidos a otros átomos. Tales comportamientos son estudiados en un laboratorio de química.
Una reacción química es la transformación de algunas sustancias en una o más sustancias diferentes. La base de tal transformación química es la reordenación de los electrones en los enlaces químicos entre los átomos. Se puede representar simbólicamente como una ecuación química, que por lo general implica átomos como la partícula central. El número de átomos a la izquierda y la derecha en la ecuación para una transformación química debe ser igual (cuando es desigual, la transformación, por definición, no es química, sino más bien una reacción nuclear o la desintegración radiactiva). El tipo de reacciones químicas que una sustancia puede experimentar y los cambios de energía que pueden acompañarla, son determinados por ciertas reglas básicas, conocidas como leyes químicas.
Las consideraciones energéticas y de entropía son variables importantes en casi todos los estudios químicos. Las sustancias químicas se clasifican en base a su estructura, estado y composiciones químicas. Estas pueden ser analizadas usando herramientas del análisis químico, como por ejemplo, la espectroscopia y cromatografía.
Varios conceptos son esenciales para el estudio de la química, y algunos de ellos son:
Materia. En química, la materia se define como cualquier cosa que tenga masa en reposo, volumen y se componga de partículas. Las partículas que componen la materia también poseen masa en reposo, sin embargo, no todas las partículas tienen masa en reposo, un ejemplo es el fotón. La materia puede ser una sustancia química pura o una mezcla de sustancias.
Átomos. El átomo es la unidad básica de la química. Se compone de un núcleo denso llamado núcleo atómico, el cual es rodeado por un espacio denominado «nube de electrones». El núcleo se compone de protones cargados positivamente y neutrones sin carga (ambos denominados nucleones). La nube de electrones son electrones que giran alrededor del núcleo, cargados negativamente.
En un átomo neutro, los electrones cargados negativamente equilibran la carga positiva de los protones. El núcleo es denso; La masa de un nucleón es 1.836 veces mayor que la de un electrón, sin embargo, el radio de un átomo es aproximadamente 10.000 veces mayor que la de su núcleo.
El átomo es la entidad más pequeña que se debe considerar para conservar las propiedades químicas del elemento, tales como la electronegatividad, el potencial de ionización, los estados de oxidación preferidos, los números de coordinación y los tipos de enlaces que un átomo prefiere formar (metálicos, iónicos , covalentes, etc).
Elemento. Un
elemento químico es una sustancia pura que se compone de un solo
tipo de átomo, caracterizado por su número particular de protones
en los núcleos de sus átomos, numero conocido como «número
atómico» y que es representados por el símbolo
![]() .
El número másico es la suma del número de protones y neutrones en
el núcleo. Aunque todos los núcleos de todos los átomos que
pertenecen a un elemento tengan el mismo número atómico, no
necesariamente deben tener el mismo número másico; átomos de un
elemento que tienen diferentes números de masa se conocen
como isótopos. Por ejemplo, todos los átomos con 6 protones en sus
núcleos son átomos de carbono, pero los átomos de carbono pueden
tener números másicos de 12 o 13.
.
El número másico es la suma del número de protones y neutrones en
el núcleo. Aunque todos los núcleos de todos los átomos que
pertenecen a un elemento tengan el mismo número atómico, no
necesariamente deben tener el mismo número másico; átomos de un
elemento que tienen diferentes números de masa se conocen
como isótopos. Por ejemplo, todos los átomos con 6 protones en sus
núcleos son átomos de carbono, pero los átomos de carbono pueden
tener números másicos de 12 o 13.
La presentación estándar de los elementos químicos está en la tabla periódica, la cual ordena los elementos por número atómico. La tabla periódica se organiza en grupos (también llamados columnas) y períodos (o filas). La tabla periódica es útil para identificar tendencias periódicas.
Compuesto. Un compuesto es una sustancia química pura compuesta de más de un elemento. Las propiedades de un compuesto tienen poca similitud con las de sus elementos. La nomenclatura estándar de los compuestos es fijado por la Unión Internacional de Química Pura y Aplicada (IUPAC). Los compuestos orgánicos se nombran según el sistema de nomenclatura orgánica. Los compuestos inorgánicos se nombran según el sistema de nomenclatura inorgánica. Además, el Servicio de Resúmenes Químicos ha ideado un método para nombrar sustancias químicas. En este esquema cada sustancia química es identificable por un número conocido como número de registro CAS.
A partir de estas definiciones abordaremos el estudio cuantitativo de la química. Todo surge de la necesidad de contar muchísimas cosas muy pequeñas.
Todos los aspectos cuantitativos de la química descansan en conocer las masas de los compuestos estudiados.
Masas atómicas
Conceptualmente, masa atómica (![]() )
es la masa de un átomo, y la masa de un átomo en particular es la
suma de las masas de sus protones y neutrones, y varía en los
distintos isótopos.
)
es la masa de un átomo, y la masa de un átomo en particular es la
suma de las masas de sus protones y neutrones, y varía en los
distintos isótopos.
Sabemos que los átomos de elementos distintos tienen distinta masa entre sí. Por ejemplo, un átomo de hidrógeno tiene distinta masa que un átomo de cobre. El átomo de cobre tiene más masa; por lo tanto, pesa más que el átomo de hidrógeno (tiene mayor peso atómico).
Los átomos son tan pequeños que no podemos medir (pesar) la masa de un átomo individualmente. No existe una balanza capaz de medir la masa de un solo átomo.
En primer lugar conviene recordar la relación entre isótopo y elemento químico.
Isótopos: Todos aquellos átomos que tienen el mismo número de protones, pero distinto número de neutrones, se dicen que son isótopos entre sí. Por tanto, tendrán el mismo número atómico y distinto número másico. Por ejemplo son isótopos del hidrógeno todos los átomos que tienen un protón, tengan los neutrones que tengan.
Elemento químico: El conjunto de todos los posibles tipos de átomos que tienen el mismo número de protones, forman un elemento químico. Por ejemplo, cuando hablamos del elemento hidrógeno, nos referimos a todos los átomos que tienen un protón.
La masa atómica de un elemento se obtiene promediando la masa de todos sus isótopos presentes en la naturaleza, teniendo en cuenta la abundancia relativa de cada uno de sus isótopos naturales. Por ejemplo, si un elemento tiene tres isótopos la masa atómica del elemento será la media ponderada de la masa de los tres. Media ponderada quiere decir que cuenta más a la hora de hacer la media el isótopo más abundante y menos el menos abundante en la naturaleza. Por esta razón se dice que las masas atómicas de los elementos son masas atómicas promedio.
Tampoco es posible contar los átomos necesarios para ajustar una determinada combinación o reacción química entre elementos distintos.
Pero lo que sí sabemos es que existe el concepto de mol, el cual representa un número definido de átomos.
Un mol se define como la cantidad de materia que
tiene tantas unidades como el número de átomos que hay en
exactamente
![]() gramos de
gramos de
![]() .
.
Se ha demostrado que este número es:
![]() .
Se lo conoce como número de Avogadro debido al científico que
realizó los ensayos para averiguar su valor.
.
Se lo conoce como número de Avogadro debido al científico que
realizó los ensayos para averiguar su valor.
El mol permite “contar” (conocer su número) entidades químicas de forma indirecta cuando son pesadas. Esta medición se puede hacer porque los átomos de un determinado elemento siempre tienen la misma masa.
Para su comprensión, diremos que tal como el
término “docena” hace referencia a una cantidad de doce
elementos cualesquiera pero iguales entre sí, el mol representa el
número
![]() .
.
Tal como es fácil colegir que la masa de una
docena de huevos (12 huevos) es distinta a la masa de una docena de
ladrillos (12 ladrillos), también la masa de un mol de hidrógeno (![]() átomos de hidrógeno) es distinta a la masa de un mol de cobre
(
átomos de hidrógeno) es distinta a la masa de un mol de cobre
(![]() átomos
de cobre).
átomos
de cobre).
Como ya lo dijimos más arriba, los distintos elementos tienen distinta masa, y el valor de cada una de sus masas ya ha sido cuantificado (tiene un valor). El valor de la masa de cada elemento nos lo entrega la conocida Tabla Periódica.
En la Tabla Periódica suele representarse el
símbolo, el nombre, el número atómico y la masa atómica relativa
![]() (o
peso atómico) de los elementos como datos básicos y, según su
complejidad, algunos otros datos sobre los elementos.
(o
peso atómico) de los elementos como datos básicos y, según su
complejidad, algunos otros datos sobre los elementos.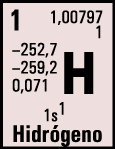
Atención, esto es lo más relevante:
Cuando en la Tabla Periódica se indica un valor para la masa atómica, hay que entender que se trata de la masa atómica relativa de los elementos, ya que ese valor de masa se obtiene al comparar la masa de cada elemento con una unidad de referencia (el valor de la masa atómica está en relación a una unidad definida). ¿Pero cuál es esa unidad de referencia?
Unidad de masa atómica
Se la llama u.m.a., que quiere decir Unidad de
Masa Atómica, aunque también puede encontrarse por su acrónimo
inglés "a.m.u." (Atomic Mass Unit). Esta unidad también
es llamada Dalton, en honor al químico con ese apellido, y
simbolizada como
![]() .
Esta última nomenclatura (
.
Esta última nomenclatura (![]() )
es la elegida por el Sistema Internacional de Magnitudes; sin
embargo, el símbolo recomendado es simplemente "
)
es la elegida por el Sistema Internacional de Magnitudes; sin
embargo, el símbolo recomendado es simplemente "![]() ".
".
Por acuerdo científico, se ha definido que su
valor es igual a la
![]() (doceava) parte de la masa del isótopo
(doceava) parte de la masa del isótopo
![]() del átomo de Carbono y su valor se corresponde aproximadamente con
la masa de un protón (o un átomo) de hidrógeno.
del átomo de Carbono y su valor se corresponde aproximadamente con
la masa de un protón (o un átomo) de hidrógeno.
Entonces, cuando se muestra un valor (un número)
como masa atómica (o peso atómico) de un elemento, ese número
está indicando cuántas veces la masa de un átomo de ese elemento
es mayor que la unidad de masa atómica. Para aclarar la idea de
relativa, debemos tomar en cuenta que para cualquier medición que
realizamos diariamente siempre consideramos una unidad de referencia.
Por ejemplo: cuando medimos el largo de una calle nuestra unidad de referencia es el metro.
Ya que mencionamos la Tabla Periódica, ¿qué leemos en ella cuando nos indica que la masa atómica del Cu = 63,54?
Debemos entender que nos dice que la masa de un
átomo de
![]() es
es
![]() veces mayor que la
veces mayor que la
![]() .,
pero no que la masa de un átomo de Cu es
.,
pero no que la masa de un átomo de Cu es
![]() g
g
En el caso del hidrógeno, indica masa atómica
del
![]() ,
debemos leer que la masa de un átomo de
,
debemos leer que la masa de un átomo de
![]() es
es
![]() veces mayor que la
veces mayor que la
![]() .,
pero no que la masa de un átomo de
.,
pero no que la masa de un átomo de
![]() es
es
![]() .
.
Anteriormente dijimos que no existe una balanza capaz de medir la masa de un solo átomo.
Pero sí ha sido posible medir (pesar) la masa de
una gran cantidad de átomos y resulta que 6![]() pesan un gramo masa; o sea, un mol de u.m.a. pesa un gramo. Es decir
que, convirtiéndola en gramos queda que
pesan un gramo masa; o sea, un mol de u.m.a. pesa un gramo. Es decir
que, convirtiéndola en gramos queda que
![]()
|
|
||
|
Mol del Helio |
Átomos del Helio |
Gramos del Helio |
|
1/4 |
1,505 x 1023 |
1 g |
|
1/2 |
3,01 x 1023 |
2 g |
|
1 |
6,02 x 1023 |
4 g |
|
2 |
1,204 x 1024 |
8 g |
|
10 |
6,02 x 1024 |
40 g |
|
Para recordar: El peso atómico (masa atómica relativa) de todos los elementos está indicado en la tabla periódica. Para cada elemento ese valor corresponde, además, al peso en gramos de un mol del mismo (6,02 x 1023 átomos del elemento). |
Masa molecular (o peso molecular)
Hasta aquí hemos hablado solo de masa de átomos,
y de sus componentes: protones y neutrones. Ahora hablarenos de masa
de moléculas (que son combinaciones de diferentes átomos).
Previamente recordemos que las moléculas, como entidad, también se
cuantifican en mol, y un mol de moléculas es igual a
![]() moléculas.
moléculas.
Sabemos que no se puede pesar la masa de una molécula individualmente. Entonces, ¿cómo calculamos la masa molecular de una sustancia? Sumando las masas atómicas relativas de los elementos que componen dicha sustancia.
Para aclarar el concepto: si una persona sube con otra sobre una balanza, ésta registra el peso combinado de ambas personas. Cuando los átomos forman moléculas, los átomos se unen y el peso de la molécula es el peso combinado de todas sus partes.
Por ejemplo, cada molécula de agua (H2O) tiene dos átomos de hidrógeno y un átomo de oxígeno. Un mol de moléculas de agua contiene dos moles de átomos de hidrógeno y un mol de átomos de oxígeno.
|
|
|||||||||||||||
|
Según esto, una botella llenada con exactamente
18,02 g de agua debería contener
![]() moléculas
de agua. Como vemos, se puede calcular el peso molecular (masa
molecular) de cualquier compuesto simplemente sumando el peso de los
átomos (masa atómica relativa) que conforman el compuesto.
moléculas
de agua. Como vemos, se puede calcular el peso molecular (masa
molecular) de cualquier compuesto simplemente sumando el peso de los
átomos (masa atómica relativa) que conforman el compuesto.
|
Cuadro resumen |
Masa y volumen molar
Llamamos
masa molar de una sustancia a la masa expresada en gramos de un mol
de moléculas o de unidades fórmula de la sustancia. También se
simboliza como
![]() y
su unidad es
y
su unidad es
![]() .
Para una sustancia compuesta como el agua, cuyas moléculas están
formadas por dos átomos de hidrógeno y uno de oxígeno, en un mol
de moléculas de agua hay dos moles de átomos de hidrógeno y un mol
de átomos de oxígeno. Como la masa de un mol de átomos de
hidrógeno es
.
Para una sustancia compuesta como el agua, cuyas moléculas están
formadas por dos átomos de hidrógeno y uno de oxígeno, en un mol
de moléculas de agua hay dos moles de átomos de hidrógeno y un mol
de átomos de oxígeno. Como la masa de un mol de átomos de
hidrógeno es
![]() . Y
la masa de un mol de átomos de oxígeno es
. Y
la masa de un mol de átomos de oxígeno es
![]() ,
la masa de un mol de moléculas de agua se calcula según
,
la masa de un mol de moléculas de agua se calcula según
![]()
La masa molar de una sustancia se obtiene sumando las masas atómicas de sus átomos expresados en gramos, tantas veces como aparezcan en la fórmula.
El volumen que ocupa una sustancia en determinadas condiciones de presión y temperatura, depende de la naturaleza y de la masa de la sustancia. Si la sustancia es un sólido o un líquido, dado que las partículas que la forman están muy próximas entre sí, el volumen suele variar poco con los cambios de presión y de temperatura. En cambio, si la sustancia es gaseosa el volumen es afectado notablemente por las variaciones de presión y de temperatura.
Llamamos volumen molar (![]() de una sustancia al volumen ocupado por un mol de unidades
elementales de la sustancia, en determinadas condiciones de presión
y temperatura.
de una sustancia al volumen ocupado por un mol de unidades
elementales de la sustancia, en determinadas condiciones de presión
y temperatura.
Si tomamos un mol de unidades elementales de una
sustancia, su masa es la masa molar
![]() , y
el volumen que ocupa, en determinadas condiciones de presión y
temperatura es el volumen molar. Si recordamos que la densidad es el
cociente entre la masa y el volumen, podemos escribir que
, y
el volumen que ocupa, en determinadas condiciones de presión y
temperatura es el volumen molar. Si recordamos que la densidad es el
cociente entre la masa y el volumen, podemos escribir que
![]()