Un átomo es la unidad básica de un elemento que puede intervenir en una combinación química. Todos los átomos tienen un núcleo, formado por protones y neutrones, alrededor del cual se encuentran los electrones. El número de protones en el núcleo coincide con el número de electrones en la nube, por lo tanto, los átomos son eléctricamente neutros.
➜ Número atómico (Z): número de protones del núcleo
➜ Número másico (A): suma de protones y neutrones
• Isótopos
![]() Son átomos que poseen el mismo número atómico pero diferente número másico
Son átomos que poseen el mismo número atómico pero diferente número másico
Iones : Un ion es una especie cargada positiva o negativamente formada a partir de átomos o moléculas que han ganado o perdido electrones como resultado de un cambio químico
- Especies isoelectrónicas: partículas que tienen el mismo número de electrones
Expresa la ubicación de los electrones de un átomo en su estado fundamental, donde los electrones van ocupando los orbitales disponibles de manera de hacer mínima la energía total del átomo.
La Configuración Electrónica Externa (CEE) es la distribución de los electrones que podrían intervenir en las uniones químicas, es decir, los electrones externos.
- Radio atómico: Es la distancia entre átomos. Aumenta frente a mayores Z en el periodo y menores Z en los grupos.
- Energía de ionización: Es la energía que se requiere para desprender un electrón. Aumenta a medida que aumentan los números atómicos de los elementos dentro de un período. Pero disminuye a medida que aumenta el número atómico en un grupo.
- Electronegatividad: Capacidad de un átomo de atraer hacia sí los electrones.
- Los átomos de muchos elementos se hallan combinados de modo tal que sus estructuras electrónicas más externas tienen 8 electrones.
- Únicamente los electrones más externos intervienen en la formaciones de enlaces. Son los Electrones de Valencia y constituyen la CEE del átomo.
- La formación de enlaces implica un reordenamiento de los EV, que se unen para dar lugar a una estructura de menor energía.
# Hay dos maneras por las cuales un átomo puede alcanzar la configuración
de un gas noble:
![]() Compartiendo electrones con otro átomo
Compartiendo electrones con otro átomo
![]() Transfiriendo electrones a otro átomo
Transfiriendo electrones a otro átomo
Tipos de enlaces
- Iónico: gran diferencia de electronegatividad(
![]() )
)
- Covalente: diferencia baja(
![]() ), entre no metales
), entre no metales
- Metálico: casi nula, entre metales
Mientras que en las uniones iónicas se da una transferencia de los electrones, por parte del átomo menos electronegativo al mayor, en las covalentes se comparten y se forman tres tipos distintos de uniones.
- Simple: dos átomos se unen por medio de un par de electrones
- Múltiple: los átomos comparten dos o tres pares de electrones
- Dativa: el par de electrones compartido es aportado sólo por uno de los átomos.
Polaridad del enlace y número de oxidación
➜ Enlace covalente polar: el par de electrones compartido no es atraído con igual intensidad por los átomos.
➜ Enlace covalente no polar: la distribución de cargas es simétrica.
El número de oxidación se refiere al número de cargas que tendría un átomo si los electrones fueran transferidos por completo al átomo más electronegativo.
NOMENCLATURA
• Compuestos binarios ➜ formados por dos tipos distintos de átomos.
- Hidruros metálicos (metal + hidrógeno)
↳
![]() hidruro de metal(m), donde m es el estado de oxidación
hidruro de metal(m), donde m es el estado de oxidación
- Hidruros no metálicos (no metal + hidrógeno)
↳
![]() nometaluro de hidrógeno
nometaluro de hidrógeno
- Óxidos metálicos (metal + oxígeno)
↳
![]() óxido de metal(m)
óxido de metal(m)
- Óxidos no metálicos (no metal + oxígeno)
↳
![]() mono/di/tri/óxido de nometal(m)
mono/di/tri/óxido de nometal(m)
- Sales binarias (metal + no metal)
![]() Compuestos iónicos
Compuestos iónicos
↳
![]() nometaluro de metal(m)
nometaluro de metal(m)
• Compuestos ternarios ➜ formados por tres tipos distintos de átomos.
- Hidróxidos (metal +
![]() )
)
![]() Compuestos iónicos
Compuestos iónicos
↳
![]() hidróxido de metal(m)
hidróxido de metal(m)
- Oxoácidos (no metal +
![]() )
)
![]() Compuestos covalentes
Compuestos covalentes
↳
![]() ácido no metálico
ácido no metálico
- Oxosales (metal + oxoanion)
![]() Compuestos iónicos
Compuestos iónicos
↳
![]() nometalito/ato de metal(m)
nometalito/ato de metal(m)
- Hidrogenosales (metal + (H+no metal))
![]() Compuestos iónicos
Compuestos iónicos
↳
![]() hidrogenonometaluro de metal(m)
hidrogenonometaluro de metal(m)
• Compuestos cuaternarios ➜ formados por cuatro tipos distintos de átomos.
- Hidrogenooxosales (metal + (H+no metal+O))
![]() Compuestos iónicos
Compuestos iónicos
↳
![]() hidrogenonometalito/ato de metal(m)
hidrogenonometalito/ato de metal(m)
GEOMETRÍA MOLECULAR Y POLARIDAD
La disposición tridimensional de los átomos en una molécula se denomina
geometría molecular. Por su parte, la polaridad de las moléculas se mide
con las suma vectorial de los momentos dipolares(
![]() ), y para eso es necesario conocer la geometría de la molécula.
), y para eso es necesario conocer la geometría de la molécula.
➜ Diatómicas: ⟶ Mismos elementos, POLAR
![]()
⟶ Distintos elementos, NO POLAR
![]()
➜ Poliatómicas:
↳ Con un átomo unido a átomos iguales
- Lineales(180°), NO POLAR
- Angulares(<120°), POLAR
- Triangulares(120°), NO POLAR
- Piramidales(<109.5°), POLAR
- Tetraédricas(109.5°), NO POLAR
↳ Con un átomo central unido a átomos diferentes, POLAR
Sólidos conductores y no conductores
Las sustancias iónicas o polares son buenos conductores de corriente.
- Sólidos iónicos: no conducen corriente eléctrica (líquidos y gaseosos si)
- Sólidos moleculares: no conducen
- Sólidos covalentes: malos conductores
- Sólidos metálicos: alta conductividad de corriente eléctrica
➜ Dipolo-dipolo: Se da entre moléculas polares. Las moléculas se atraen por los extremos con carga opuesta
➜ London: Se produce por la formación sucesiva de dipolos instantáneos a partir del movimiento de los electrones
➜ Puente de hidrógeno: Es la atracción de átomos de hidrógeno unidos a un átomo altamente electronegativo y al par electrónico sin compartir de otro.
MAGNITUDES ATÓMICAS Y MOLECULARES
Los átomos son partículas extremadamente pequeñas, por lo tanto, no es
posible pesar un solo átomo, es por eso que se asigna un valor a la masa de
un átomo de un elemento determinado para utilizarlo como referencia. La
unidad de masa atómica, es la doceava parte de la masa de un átomo de
![]() .
.
La
masa atómica
es la masa de un
![]()
átomo. Es un promedio entre la
masa de los isótopos que hay en un elemento, y es posible expresarla en umas o en gramos.
La masa molecular , por su parte es la suma de las masas atómica dentro de una molécula.
El mol es la unidad de cantidad de sustancia, y su valor es de
![]() unidades, siendo esta la cantidad de átomos que hay en 12 gramos de
unidades, siendo esta la cantidad de átomos que hay en 12 gramos de
![]()
La masa molar es la masa de un mol, que se mide en g/mol. Coincide numéricamente con la masa atómica y con la masa molecular, expresadas en u.
El
volumen molar
![]() es el volumen de un mol, y se calcula como,
es el volumen de un mol, y se calcula como,
![]()
Una solución(sc) o disolución es una mezcla homogénea de dos o más sustancias.
- Sustancia disuelta: soluto(st)
- Sustancia disolvente: solvente(sv)
⤷ Se lleva a cabo en tres etapas diferentes. La primera es la separación de las moléculas de solvente y la segunda de las partículas que forman el soluto. En la tercera etapa se produce la mezcla y atracción de las moléculas de solvente y del soluto.
⤷ Depende de la fuerza entre las interacciones: st-st, sv-sv, st-sv
⤷ Un soluto se disuelve cuando las fuerzas de atracción entre las moléculas del soluto y solvente son más intensas que entre las que actúan entre las moléculas del soluto.
⤷ Las sustancias polares se disuelven en solventes polares y las no polares en solventes no polares.
La concentración de una solución es el número de partes de soluto que hay en un determinado número de partes de solución o de solvente. Existen diferentes formas de calcularla y expresarla.
● (%m/m) Porcentaje masa/masa: Indica gramos de st cada 100 g sc
● (%m/v) Porcentaje masa/volumen: gramos de st cada 100
![]() sc
sc
● (%v/v) Porcentaje volumen/volumen:
![]() de st cada 100
de st cada 100
![]() sc
sc
● (M) Molaridad: cantidad de st (en mol) en 1
![]() sc
sc
● (m) Molalidad: cantidad de st (en mol) por 1 kg sc
● (
![]() ) Fracción molar: relación entre moles de st/sv y número total de moles de
sc
) Fracción molar: relación entre moles de st/sv y número total de moles de
sc
● (Ppm) Partes por millón: gramos de soluto cada 1000 kg sc
Clasificación de solutos
Los solutos que se disuelven en agua se clasifican en electrolitos y no electrolitos. Un electrólito es una sustancia que, al disolverse en agua, forma una solución que conduce la corriente eléctrica, por el contrario un no electrólito al disolverse en agua no conduce la corriente eléctrica.
• Teoría cinética •
- Los gases están constituidos por moléculas que al estar tan alejadas no se ejercen fuerzas entre sí
- Las moléculas se mueven al azar y en línea recta, chocando entre sí o contra las paredes del recipiente. Estos choques son perfectamente elásticos (no se pierde energía)
- La velocidad media y la energía cinética media de las moléculas del gas son
proporcionales a la temperatura.
Variables de estado
Propiedades macroscópicas, variables cuyos valores dependen del estado del sistema
➜ Presión: Fuerza que ejercen las moléculas del gas cuando chocan contra
las paredes del recipiente.
![]()
![]()
➜ Volumen: Todos los gases ocupan el volumen al mismo tiempo. A mayor volumen, las moléculas están más dispersas.
➜ Temperatura: Relacionada con el movimiento de las moléculas. a mayor
temperatura aumenta el movimiento, por lo tanto la cantidad de choques
contra las paredes del recipiente(presión)
![]()
- Ley de Boyle (relación Presión-Volumen)
Para una una cantidad fija de gas(n), mantenida a temperatura constante, el
producto entre presión y volumen es constante(
![]() ), siendo
), siendo
![]()
Esto predice de qué manera se verá afectado la presión o el volumen cuando
se modifique una de estas variables
![]()
- Ley de Charles y Gay-Lussac (relación Temperatura-Volumen)
El volumen de una cantidad fija de un gas, a presión constante, es
directamente proporcional a su temperatura absoluta(
![]() ), donde
), donde
![]()
Es posible comparar dos condiciones de volumen y temperatura para una
muestra dada de un gas a presión constante
![]()
- Segunda ley de Charles (relación Presión-Temperatura)
Para una cantidad de gas a volumen constante, la presión del gas es
directamente proporcional a la temperatura(
![]() ), donde
), donde
![]()
- Ley de Avogadro (relación Volumen-Cantidad)
Volúmenes iguales de diferentes gases, a temperatura y presión constantes,
contienen el mismo número de moléculas. El volumen de cualquier gas es
proporcional al número de moles de moléculas presentes(
![]() ), donde
), donde
![]()
El gas ideal es un gas hipotético, donde las moléculas no se atraen o se repelen entre sí, es decir, no hay interacción entre las moléculas y cuyo comportamiento de presión, volumen y temperatura se puede describir completamente por la ecuación del gas ideal.
![]()
En las condiciones normales de presión(1 atm) y temperatura(273,15 K), 1
mol de gas ideal ocupa 22,4 L(1
![]() ). entonces:
). entonces:
![]()
Cálculo de densidad(δ) y masa molar:
Dado que n es la relación entre la masa y la masa molar:
![]()
A partir de la ecuación del gas ideal se puede calcular la densidad de un
gas mediante:
![]()
Por lo tanto también se puede calcular la masa molar como:
![]()
Ley de Dalton(Presiones parciales)
En las mezclas de gases, la presión total es la suma de las presiones que
ejercen cada uno de los gases presentes en dicha mezcla.
![]()
La fracción molar relaciona la cantidad de moléculas de un componente y la
cantidad de moléculas de todos los componentes presentes:
![]() . A partir de la fracción molar y la presión total se puede calcular la
presión parcial de un gas:
. A partir de la fracción molar y la presión total se puede calcular la
presión parcial de un gas:
![]()
REACCIONES QUÍMICAS
- Es un proceso en el que las sustancias llamadas reactivos sufren un reordenamiento de las partículas que intervienen debido a la ruptura y formación de enlaces, dando lugar a nuevas sustancias denominadas productos.
- Durante la reacción se absorbe o se libera energía, sin embargo siempre se cumple la ley de conservación de la masa.
- Se representan mediante ecuaciones que tienen que estar balanceadas con respecto a lo anterior
Balanceo de ecuaciones
Hay dos tipos de reacciones químicas:
➜ Reacciones donde no hay cambio en los numeros de oxidacion de reactivos y productos. Las ecuaciones químicas de estas reacciones pueden igualarse por tanteo.
➜ Reacciones de óxido-reducción (redox) , donde uno o más reactivos cambian su número de oxidación al transformarse a productos. A su vez se clasifican en:
- Reacciones en vía seca: se destacan por la ausencia de
![]() , y se balancean mediante el método del número de oxidación
, y se balancean mediante el método del número de oxidación
- Reacciones en vía húmeda: se reconocen por la presencia de
![]() , y porque las sustancias se encuentran en solución acuosa(ac). Dependiendo
del pH hay reacciones en medio ácido o básico, pero ambas se balancean con
el metodo ion-electron.
, y porque las sustancias se encuentran en solución acuosa(ac). Dependiendo
del pH hay reacciones en medio ácido o básico, pero ambas se balancean con
el metodo ion-electron.
Métodos para balancear ecuaciones redox
1- Determinar los números de oxidación de todos los átomos que intervienen.
2- Identificar cambios en estos.
3- Plantear dos hemiecuaciones (oxidación y reducción), y efectuar el balance estequiométrico y eléctrico.
4- Igualar el número de electrones entre las hemiecuaciones.
5- Sumar miembro a miembro y simplificar electrones.
6- Igualar la ecuación global
7- Verificar
1- Ionizar electrolitos fuertes (ácidos, bases o sales). No se ionizan el agua, los gases o los óxidos.
2- Identificar el medio. Si ocurre en medio ácido intervienen oxoácidos o hidrácidos, si en cambio ocurre en medio básico, hidróxidos.
3- Determinar los números de oxidación.
4- Identificar las especies donde haya cambios en estos.
5- Plantear las hemiecuaciones, con iones o moléculas, según corresponda, y efectuar el balance eléctrico.
6- Balancear estequiométricamente.
- En medio ácido: la diferencia de oxígenos se iguala con moléculas de
agua. Y luego se balancea al otro lado de la ecuación con
![]()
- En medio básico: la diferencia de oxígenos indica el número de moléculas
de agua que hay que agregar donde hay mayor cantidad de oxígeno. Luego se
balancea al otro lado con
![]()
7- Igualar el número de electrones entre las hemiecuaciones.
8- Igualar la ecuación global.
9- Verificar
➜
Pureza
: Se expresa en porcentaje y es la masa de sustancia (pura) presente cada
100 g de muestra.
![]()
➜ Reactivo limitante : Es el reactivo que se consume primero en la reacción y que limita la cantidad de producto que se puede formar.
➜
Rendimiento
: El % de rendimiento indica la cantidad de producto que se obtiene en la
práctica en relación a la cantidad teórica que debería obtenerse según la
ecuación estequiométrica.
![]()
El equilibrio químico es un estado de la reacción química en el cual tienen lugar simultáneamente una reacción directa y su inversa a la misma velocidad y no existe una conversión neta de reactivos a productos ni de productos a reactivos.
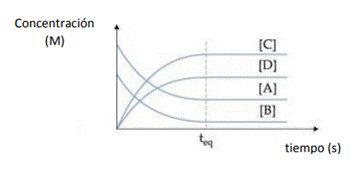
![]()
En el gráfico se ve como la concentración de los reactivos disminuye
mientras la concentración de productos aumenta hasta llegar al equilibrio, donde las concentraciones permanecen constantes en el tiempo.
- La velocidad de la reacción se expresa como
![]()
- Cuando se alcanza el equilibrio la velocidad de reactivos y productos es
la misma. Por lo tanto
![]() , que es igual a
, que es igual a
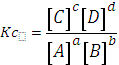
![]()
- La “concentración” de los sólidos y los líquidos es constante y por lo tanto, se pueden incluir dentro del valor de Kc.
Para las reacciones que no han alcanzado el estado de equilibrio, se puede obtener un cociente de reacción (Qc), al sustituir las concentraciones en el equilibrio por las concentraciones en otro momento de la reacción, en la expresión de Kc.
Luego, comparando los valores de Qc con Kc hay tres posibilidades:
-
![]() como Qc debe achicarse, se consumen productos y se generan reactivos.
como Qc debe achicarse, se consumen productos y se generan reactivos.
-
![]() el sistema está en equilibrio.
el sistema está en equilibrio.
-
![]() Qc debe aumentar, entonces los reactivos se consumen y se forman los
productos.
Qc debe aumentar, entonces los reactivos se consumen y se forman los
productos.
Principio de Le Chatelier
Un sistema puede salir del equilibrio si se perturba con cambios en la concentración, la presión, el volumen o la temperatura. El principio de Le Chatelier establece que si se perturba un sistema en equilibrio, el sistema responderá de manera de contrarrestar dicha perturbación y alcanzar un nuevo estado de equilibrio.
- Concentración de reactivos o productos. Como cambia el cociente de reacción, el sistema evoluciona hacia los reactivos(se forman reactivos) si el cambio se produjo por adición de productos, o se evoluciona hacia productos, si se agregan reactivos.
- Volumen y presión. La presión está directamente relacionada con la concentración (P=n/V), por lo tanto si hay un aumento en la presión o disminuye el volumen, el sistema va a evolucionar hacia el lado donde produzca menor cantidad de moles. Si aumenta el volumen o baja la presión, evoluciona para generar más cantidad de moléculas.
-
Temperatura
. En los sistemas en equilibrio hay siempre una reacción endotérmica (
![]() ), que absorbe calor, y otra exotérmica (
), que absorbe calor, y otra exotérmica (
![]() ), que lo libera. Al cambiar la temperatura, el sistema va a disminuir la
perturbación al evolucionar y favorecer un tipo de reacción, lo que va a
cambiar las concentraciones entre productos, cambiando también la constante
de equilibrio.
), que lo libera. Al cambiar la temperatura, el sistema va a disminuir la
perturbación al evolucionar y favorecer un tipo de reacción, lo que va a
cambiar las concentraciones entre productos, cambiando también la constante
de equilibrio.
Acidos y bases
- Un ácido se define como una sustancia capaz de ceder un protón.
- Una base, como una sustancia capaz de aceptarlo.
El par ácido-base conjugado es una extensión de esta definición. La base conjugada es la especie que resulta cuando el ácida pierde un protón. Y el ácido conjugado, la que surge después de que la base gane el protón
Autoionización del agua
![]()
El agua es un electrolito débil que se ioniza parcialmente. Su constante de
equilibrio está dada por
![]() .
.
Dependiendo la concentraciones molares de oxonio e hidroxido, las soluciones se clasifican en:
- Neutras:
![]()
- Ácidas:
![]()
- Básicas:
![]()
Dado que los valores de las concentraciones de los iones H3O + y OH generalmente son muy pequeños, se utilizan las medidas de:
- pH: logaritmo decimal negativo de la concentración molar del ion
hidrógeno, en moles/L
![]()
- pOH: logaritmo decimal negativo de la concentración molar del ion
hidroxilo, en moles/L
![]()
Reemplazando esto en la fórmula de
![]() , se obtiene que:
, se obtiene que:
![]() . Por lo tanto en las soluciones neutras,
. Por lo tanto en las soluciones neutras,
![]() En las ácidas,
En las ácidas,
![]() Y en las básicas,
Y en las básicas,
![]()
Fuerza y constante de ionización de bases y acidos
- Las bases y ácidos fuertes son electrolitos fuertes, es decir, que se ionizan por completo y la reacción es irreversible.
- Las bases y ácidos débiles son electrolitos débiles, por lo tanto, se ionizan sólo parcialmente en agua y el proceso de ionización es reversible.
Como la mayoría de los ácidos y bases son electrolitos débiles que se ionizan parcialmente en agua, se puede calcular su constante de ionización.
- Para las acidos:
![]()
- Para las bases:
![]()