|
Física e Introducción a la Biofísica 1P2C2019 23/10/19
TEMA 11
|
APELLIDO: |
SOBRE Nº: |
|
NOMBRES: |
Duración del examen: 1.30hs |
|
|
DNI/CI/LC/LE/PAS. Nº: |
CALIFICACIÓN: Apellido del evaluador: |
Lea atentamente cada pregunta y responda en los espacios pautados. Para las preguntas de opción múltiple marque con una X la opción correspondiente a la respuesta correcta. En todos los casos, marque una y sólo una opción . Si marca más de una opción, la pregunta será anulada.
Ejercicio N°1 (1 punto)
Una pelota es lanzada hacia arriba con una velocidad de 57 km/h. A qué distancia de su punto de partida se encuentra la misma cuando alcanza una velocidad de 0,5 m/s. Exprese el resultado en m
Datos: g = 9,8 m/s2
Tiro Vertical
Yo= 0m ; Vo= 57Km/h = 57000m/3600s = 15,833m/s ; Vf=0,5m/s ; g= -9,8m/s 2 (por sistema de referencia)
Vf = Vo + g . t
0,5m/s = 15,833m/s + (-9,8m/s2) . t
t= 1,564s
Yf = Yo + Vo . t + ½ g . t2
Yf = 0m + 15,833m/s . 1,564s + ½ .( -9,8m/s2) .
(1,564s)2
Yf= 12,776 m
Respuesta: …….…12,776 m
Ejercicio N°2 (1 punto)
Determine la cantidad de veces que hay que dejar caer las 2 pesas en un recipiente similar al utilizado por Joule, desde una altura de 1,8 m, para lograr una variación de temperatura de 0,92 K si el volumen de agua es de 567 ml
Datos: δ agua = 1 g/cm3 ; Ce agua = 1 cal/g °C; Peso de cada pesa = 9,71 N; 1 cal = 4,18 J; g = 9,8 m/s2
Q = m . Ce . (Tf – Ti); 567cm3 . 1 g/cm3 = 567g
Q = 567g . 1cal/g °C . 0,92°C
Q= 521,64 cal
2 cal = 8,31 Joule ; 521,64 cal . 8,31 J / 2 cal = 2180,45 Joule (J = N.m)
W = 2 . n . P . h
2180,45 J = 2. n . 9,71N . 1,8m
n= 62,37 > se deben dejar caer 63 veces.
Respuesta: ……63 veces.
Ejercicio N°3 (1 punto)
Marque con una cruz la opción que complete la siguiente oración:
Cuando un cuerpo se desplaza de un punto a otro con un MRU………..
|
a) Su energía cinética sólo puede ser determinada en caso de conocer su velocidad y su masa. Se puede medir en watt |
|
|
X |
b) Su energía cinética tiene relación directa con su masa y se mantiene constante a lo largo del trayecto descripto por el cuerpo |
|
c) Su energía cinética es directamente proporcional a la altura respecto de un plano de referencia y se puede medir en joule |
|
|
|
d) Su energía cinética es directamente proporcional a la velocidad del mismo y no depende de su masa |
Ec= ½ m . v2 ; siendo la velocidad constante en MRU
Ejercicio N°4 (1 punto)
Dado un recipiente adiabático que contiene una masa inicial de hielo a -30° C, se introduce un cuerpo de 400 g en estado sólido (Ce = 0,39 cal/g °C) y pasa de una temperatura de 388K a una temperatura final de 285 K. Calcule la masa inicial de hielo. Datos: Ce hielo = 0,5 cal/g °C; Ce agua = 1 cal/g °C; C fusión hielo = 80 cal/g
Qa + Qc = 0 ; Qa= Qsensible hielo + Qfusion + Qsensible agua ; 388°K = 115°C ; 285°K = 12°C ; (Tf – Ti) cuerpo= -103°C
m hielo . Cehielo (Tf – Ti) + m hielo . Cfusiónhielo + magua/hielo . Ceagua (Tf – Ti)agua + mcuerpo . Ce cuerpo (Tf – Ti)cuerpo = 0
m hielo . 0,5cal/g °c . 30°C + mhielo . 80cal/g + magua/hielo . 1 cal/g °c . 12°C + 400g . 0,39 cal/g °C . -103°C = 0
m hielo . 15cal/g + mhielo . 80cal/g + m agua/hielo . 12 cal/g + (-16068 cal) = 0
m hielo . 107cal/g = 16068cal
m hielo = 150,17
Respuesta: ………150,17g
Ejercicio N°5 (1 punto)
Determine el número de moles de oxígeno en una mezcla de gases que se encuentra en un recipiente adiabático de 3 dm de alto, 40 cm de ancho y 0,6 m de profundidad. La mezcla ejerce una presión de 1427 mmHg siendo el 27 % de la misma ocupada por oxígeno. La misma se encuentra a -23 °C
Datos: R= 0,082 l.atm/K.mol; 760 mmHg = 1 atm = 1,013x106 barias = 1,013x105 pascales
30cm alto . 40cm ancho . 60cm profundidad =72000cm3 = 72L ; P.V=n.R.T ; -23°C= 250°K
760mmHg_____1atm
1427mmHg____ 1,877atm
1,877atm . 72L = ntotales . 0,082L.atm/K.mol . 250°K
ntotales = 6,592moles
noxigeno = 6,592moles . 0,27
noxigeno = 1,779moles
Respuesta:………… 1,779moles
Ejercicio N°6 (1 punto)
En una habitación se mide la humedad relativa en 3 días diferentes del año, denominados A, B y C. En el día A la temperatura ambiente fue de 22°C, en el día B fue de 281 K y el día C fue de 39°C. Indique qué día presentó la mayor humedad relativa.
TA= 22°C ;TB = 281°K = 8°C ; TC= 39°C
Rta: B, a menor T, menor Pv y mayor HR
Ejercicio N°7 (1 punto)
Considerando el principio de Pascal y observando el siguiente esquema, marque con una cruz la opción correcta:
Dato: A2 = 1/5 A1
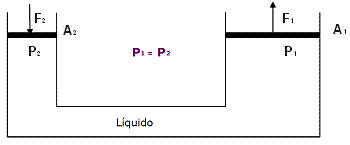
|
a) F2.A2 = F1.A 1 |
|
|
b) F2 = F1 |
|
|
c) F2 > F1 |
|
|
X |
d) F2 < F1 |
F1 / A1 = F2 / A2 , siendo A2 < A1 , F2 < F1
Ejercicio N°8 (1 punto) Marque con una X la opción correcta
A partir de las características de la transmisión de calor marque con una cruz la respuesta correcta:
|
a) La conducción se puede producir entre dos extremos de un sólido que se encuentran a la misma temperatura. |
|
|
b) La radiación se puede dar en el vacío y el calor transmitido puede determinarse mediante la ley de Fourier. |
|
|
c) La conducción se produce entre dos líquidos a diferente temperatura. |
|
|
X |
d) La convección puede darse tanto en líquidos como en gases y no se corresponde con la ley de Fourier. |
Ejercicio N°9 (1 punto)
dimensiones: 0,4m . 0,1m . 0,3m=0,012m3 ; HR= H absoluta/H máxima
0,25= 3750 g/m3 / H máxima
15000 g/m3 = H máxima
1m3________15000g
0,012m3_____ 180g
Respuesta:…………. 180g
Ejercicio N°10 (1 punto)
Determine la variación de energía interna (en calorías) de un proceso donde 45 g de un gas ideal se expanden a una presión constante de 0,3 atm siendo la variación de volumen de 2,5 L y la variación de temperatura de 12 K,
Datos: Cep = 0,24 cal/g °C; R = 0,082 l atm/mol K = 2 cal/mol K = 8,31 J/mol K
W=P.(Vf-Vi) ; ΔT=12°C ; ΔU=Q-W
W= 0,3atm . 2,5 L = 0,75 L.atm
Q= m . Ce . Δ T
Q= 45g . 0,24 cal/g °C . 12°C
2cal = 0,082 L.atm ; Q= 129,6 cal . 0,082 L.atm/2cal = 5,31 L.atm
Δ U= 5,31 L.atm - 0,75 L.atm
ΔU= 4,56 L.atm = 111,219 cal
Respuesta: …………..111,219 cal
